人教版 高中《化学》必修1第三章
第二节 几种重要的金属化合物 第1课时,共3课时
【教学目标】
知识与技能目标:
1.了解钠的氧化物的物理化学性质;
2.认识金属氧化物的主要性质;认识碳酸钠和碳酸氢钠的不同点。
【过程与方法】
1.培养学生的观察能力;训练学生运用对比的方法认识事物和全面地分析事物的逻辑思维能力;完善学生的实验能力和创造思维能力。
2.尝试用分类方法学习物质的性质。
【教学重点与难点】
重点:钠的氧化物的性质
难点:碳酸钠和碳酸氢钠的比较
【教学过程】
1.氧化钠和过氧化钠
复习:金属单质的化学性质:与氧气反应、与水反应、与碱反应。
导入:氧化铝、氢氧化铝、铝盐都含铝元素,但因组成不同而性质不同;氧化钠、氧化铝、氧化铜、氧化铁虽然都是氧化物,但由于所含的金属元素不同,性质不同。不同类型的金属化合物性质也不同。今节课我们研究几种重要的金属化合物。
思考交流:指导学生阅读课本P55相关内容,并思考课本里面提出的两个问题。
归纳整理:1、氧化纳是白色固体,而过氧化纳是淡黄色固体。
2、Na2O+H2O=2NaOH
实验探究:由学生演示课本P55实验3-5,指导学生观察并记录实验现象。
归纳整理:现象——滴入水后有大量气泡产生;气体使带有火星的木条复燃;试管外壁发热;向溶液滴入酚酞后,溶液颜色变红。
化学方程式:2Na2O2+2H2O=4NaOH+O2↑
过氧化纳的用途:常作强氧化剂,用于漂白织物、麦秆、羽毛。
推进新课:过氧化钠还能与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2;所以常用作呼吸面具上和潜艇里的供氧剂。
练习:写出过氧化钠与盐酸反应的化学方程式:2Na2O2+4HCl = 4NaCl+2H2O +O2↑
问:过氧化钠是碱性氧化物吗?
归纳:不是。因为过氧化钠与酸反应,除了生成盐和水外,还生成氧气。
投影:氧化钠和过氧化钠的比较
2.碳酸钠和碳酸氢钠
播放VR/3D教学视频(高中化学-无机化学-金属碳酸盐与酸的反应),了解碳酸钠与酸的反应。
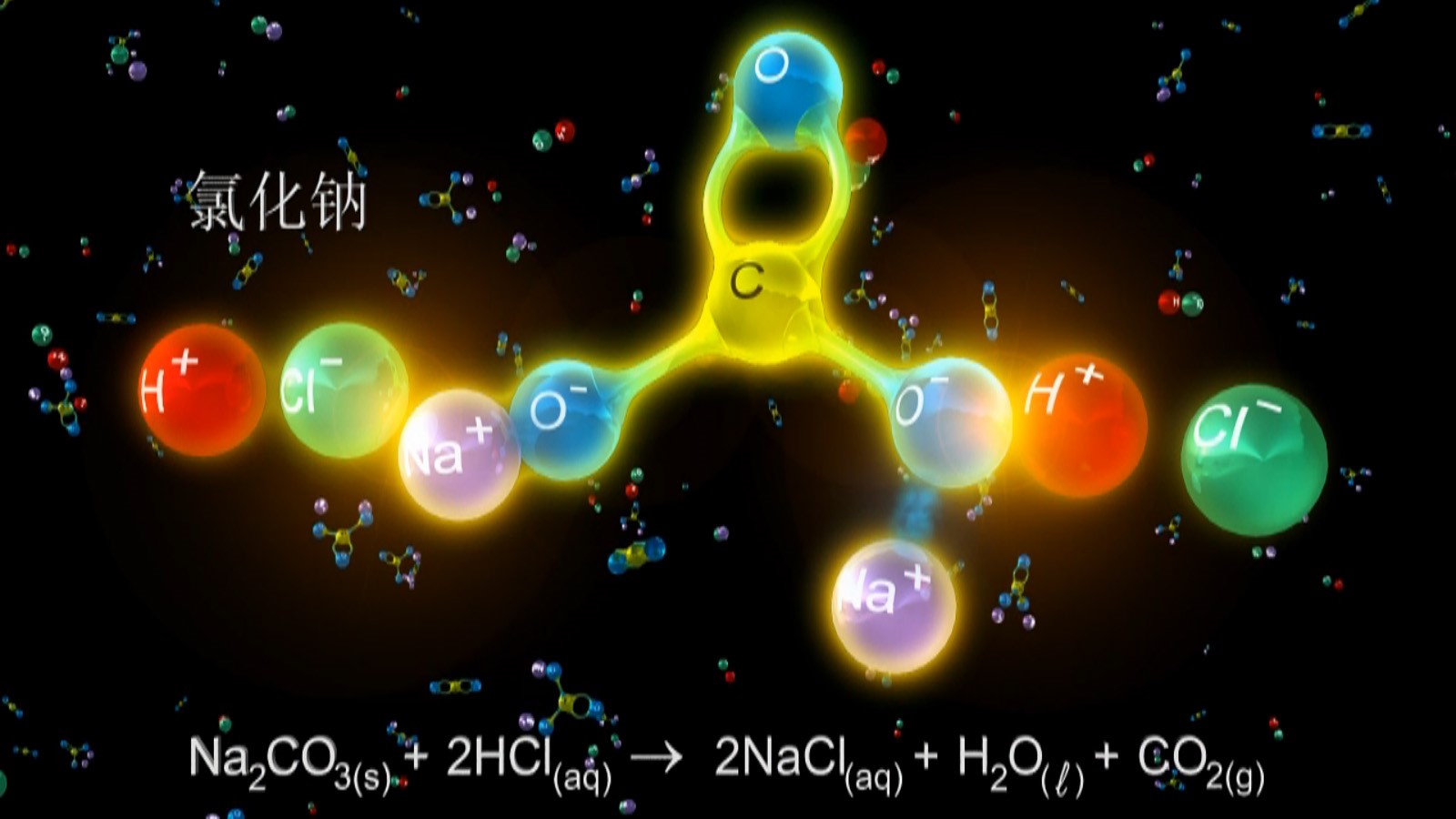

问:在面粉发酵或油条制作时常常用到纯碱或小苏打,你知道纯碱、小苏打的成分是什么吗? 它们的化学性质有什么区别?
实验探究:指导学生完成课本P56科学探究实验:1、Na2CO3、NaHCO3在水中的溶解性实验;2、Na2CO3、Na2CO3的热稳定性;3、补充实验——Na2CO3、NaHCO3分别与稀盐酸、石灰水、CaCl2的反应。观察并记录实验现象。
应用实践:
(1)如何鉴别Na2CO3、NaHCO3两种固体?如果是溶液,又如何鉴别?
(2)在Na2CO3中混有NaHCO3,如何除去?在NaHCO3中混有Na2CO3又如何除去?
(3)用途:Na2CO3用于制玻璃、肥皂、造纸和纺织等;NaHCO3则用作发酵剂、灭火剂和制药等。
归纳整理:
Na2CO3 | NaHCO3 | |
俗名 | 纯碱 苏打 | 小苏打 |
颜色状态 | 白色固体 | 白色固体 |
溶解性 | 都能溶解于水,但 Na2CO3的溶解度大于NaHCO3的溶解度 | |
用途 | 制玻璃、造纸、制肥皂、纺织工业 | 发酵粉的主要成分、治疗胃酸过多、泡沫灭火 |
与盐酸反应 | Na2CO3+2HCl=2NaCl+CO2+H2O 若逐滴滴加盐酸反应先后顺序为: Na2CO3+HCl=NaCl+NaHCO3 NaHCO3+HCl=NaCl+CO2+H2O | NaHCO3+HCl=NaCl+CO2+H2O NaHCO3与盐酸反应的剧烈程度大于Na2CO3与盐酸反应的剧烈程度 |
与NaOH溶液反应 | 不反应 | NaHCO3+NaOH=Na2CO3+H2O |
与Ca(OH)2溶液反应 | 产生白色沉淀 Na2CO3+Ca(OH)2=CaCO3+2NaOH | 产生白色沉淀 2NaHCO3+Ca(OH)2=CaCO3+Na2CO3+2H2O |
与CaCl2溶液反应 | 产生白色沉淀 Na2CO3+CaCl2=CaCO3+2NaCl | 不反应 |
与CO2反应
| Na2CO3+CO2+H2O=2NaHCO3 若向饱和的Na2CO3溶液中通入CO2气体,溶液中析出白色固体,因为NaHCO3的溶解度小于Na2CO3的溶解 | 不反应 |
热稳定性 | 稳定,受热不分解 | 2NaHCO3====Na2CO3+CO2+H2O |
3.焰色反应
问:大家知道节日燃放的五彩缤纷的烟花是怎么来的吗?
讲述:很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应。
播放视频:[实验3—6]
小结:节日燃放的五彩缤纷的烟花,就是碱金属,以及锶、钡等金属化合物所呈现的各种艳丽的色彩。所以焰色反应常用于鉴别物质。
作业:课本P63第12题